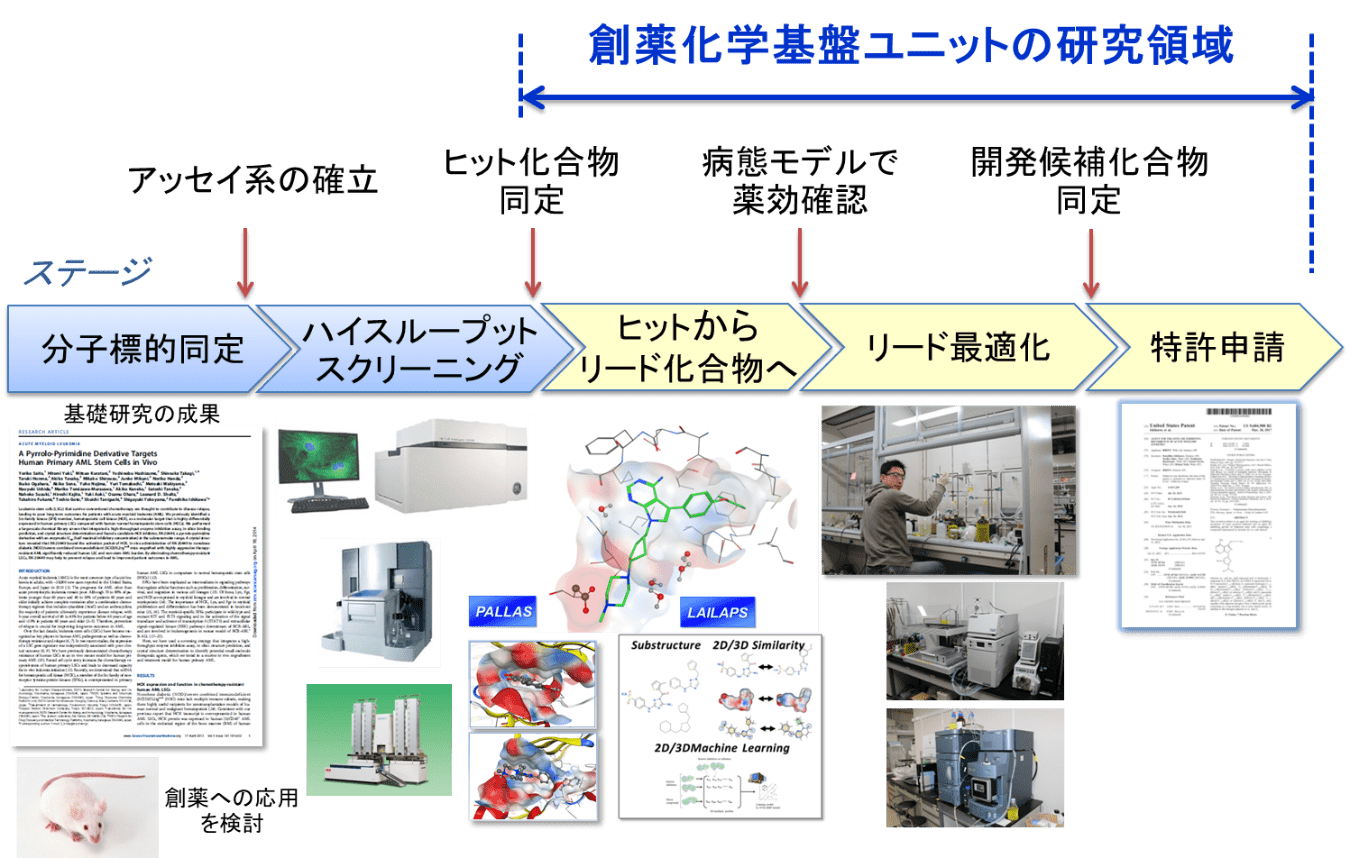
リードジェネレーション(lead generation、Hit to lead (H2L)としても知られる)は、創薬の初期段階であり、ハイスループットスクリーニング (HTS) からの低分子ヒット化合物が評価され、限定された最適化を経て有望なリード化合物を同定する。これらのリード化合物は、リード最適化 (LO) と呼ばれる創薬の後続ステップでより広範な最適化を受ける。一般的に、創薬プロセスは、ヒットからリードまでの段階を含む次のパスに従う。
- ターゲットバリデーション (TV) → アッセイ開発 → ハイスループットスクリーニング (HTS) → リードジェネレーション (Hit to lead; H2L) → リード最適化 (LO) → 前臨床開発 → 臨床開発 (英語版)
リードジェネレーション段階は、ハイスループットスクリーニング (HTS) のヒット確認と評価から始まり、続いてアナログの合成 (ヒットエクスパンジョン) が行われる。通常、最初のスクリーニングヒットはマイクロモル (10-6モル濃度) の範囲の生物学的ターゲットに対する結合親和性を示す。リードジェネレーションの限定的な最適化により、ヒットの親和性はナノモル (10-9M) の範囲まで数桁改善されることがよくある。また、ヒット化合物は、代謝半減期を改善するために限定的な最適化を受け、その結果、化合物を疾患の動物モデル (英語版) で試験できるようにし、望ましくない副作用をもたらす可能性のある他の生物学的ターゲットに対する結合選択性 (英語版) も改善する。
平均して、創薬から前臨床開発の段階に入る 5,000 化合物につき 1つの割合で承認された薬剤になる。
ヒット確認
ハイスループットスクリーンからヒット化合物が同定された後、以下の方法でヒット化合物を確認し、評価する。
- 確認試験(Confirmatory testing): 選択したターゲットに対して活性が認められた化合物は、活性が再現可能であることを確認するために、HTSで使用したのと同じアッセイ条件を使用して再試験する。
- 用量反応曲線(Dose response curve): 化合物をある濃度範囲で試験し、最大の結合または活性を半分になる濃度を決定する。(それぞれIC50またはEC50値)
- 直交試験(Orthogonal testing): 確認されたヒット化合物は、通常はターゲットの生理学的条件に近いアッセイ法を使用して、または異なる技術を使用したアッセイ法を使用して評価される。
- 二次スクリーニング: 確認されたヒット化合物は、機能的細胞アッセイ(functional cellular assay)で試験され、固有活性 (英語版) が判定される。
- 合成作業性(Synthetic tractability): 創薬化学者は、合成の実現可能性や、アップスケーリング、商品コストなどの他のパラメータに従って化合物を評価する。
- 生物物理学的試験: 核磁気共鳴 (NMR)、等温滴定カロリメトリー (ITC)、動的光散乱 (DLS)、表面プラズモン共鳴 (SPR)、二重偏光干渉 (DPI)、マイクロスケール熱泳動 (MST) は一般に、化合物がターゲットに効果的に結合するかどうか、結合の速度論、熱力学、化学量論、関連するコンホメーション変化を評価し、プロミスキャス結合を除外するために使用される。
- ヒットランキングとクラスタリング: 確認されたヒット化合物は、様々なヒット確認実験に基づいてランク付けされる。
- 特許権侵害評価: ヒットした化合物の構造を、専門のデータベースでチェックし、特許性があるかどうかを判断する。
ヒットエクスパンジョン
ヒット確認に続いて、事前に定義されたテストの特性に従って、いくつかの化合物クラスターが選択される。理想的な化合物クラスターは、以下を有するメンバーを含む。
- ターゲットに対する高い親和性(1μM未満)。
- 他のターゲットに対する選択性
- 細胞アッセイでの有意な有効性固有活性
- 薬らしさ(druglikeness) (通常、中程度の分子量と親油性は ClogP と推定される)。親和性、分子量、親油性は、リガンド効率および親油性効率のような単一のパラメータでリンクできる。
- ヒト血清アルブミンへの低〜中程度の結合性
- P450酵素やP糖タンパク質との干渉が少ない
- 低い細胞毒性
- 代謝安定性 (metabolic stability)
- 高い細胞膜透過性 (cell membrane permeability)
- 高い水溶性 (water solubility) (10 μM以上)
- 化学的安定性 (chemical stability)
- 合成作業性 (synthetic tractability)
- 特許性 (patentability)
プロジェクトチームは通常、さらに精査をするため、3~6種類の化合物シリーズを選択する。次のステップでは、類似化合物を試験して定量的構造活性相関 (QSAR) を決定できる。アナログは、内部ライブラリから迅速に選択するか、または市販のソースから購入できる (「カタログSAR」または「購入SAR」)。創薬化学者はまた、コンビナトリアルケミストリー、ハイスループットケミストリー、またはより古典的な有機化学合成などのさまざまな方法を用いて、関連化合物の合成を開始する。
リード最適化
この創薬段階の目的は、リード化合物の合成、効力が向上しオフターゲット効果を低減した新規アナログ、および合理的な in vivo 薬物動態を示唆する生理化学的/代謝特性を合成することである。この最適化は、ヒットした構造の化学修飾によって達成され、構造活性相関 (SAR) (英語版) の知識と、ターゲットに関する構造情報が利用可能な場合は構造ベースの設計を利用して修飾を選択する。
リード最適化は、動物有効性モデルや ADMET (in vitroとin situ) ツールに基づいた化合物の実験的試験と確認に関係しており、その後、ターゲット同定やターゲットバリデーション (TV) が行われる。
脚注
関連項目
- ケモインフォマティクス
- 医薬品設計
- 医薬品開発
- 薬物代謝
- ハイスループットスクリーニング (HTS)
- 医薬品設計#合理的医薬品設計